 |
|
Популярные авторы:: Андерсон Пол Уильям :: Говард Роберт Ирвин :: Дойл Артур Конан :: Кларк Артур Чарльз :: Кукаркин Евгений :: Желязны Роджер :: Бёлль Генрих :: СССР Внутренний Предиктор :: Станюкович Константин Михайлович :: Нортон Андрэ Популярные книги:: Справочник по реестру Windows XP :: Звездный удар :: Смерть Эльзы Басколет :: Рабыня Гора :: Домашний ёж :: Пришельцы из космоса :: «О текущем моменте», № 4(52) 2006 г. :: «Простите нас!» :: Снежная страна :: Голоса в темноте |
Большая Советская Энциклопедия (УГ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (УГ) - Чтение (стр. 3)
У. принято делить на три основных группы: моносахариды, олигосахариды и полисахариды. Обычные моносахариды представляют собой полиокси-альдегиды (альдозы) или полпоксикетоны (кетозы) с линейной цепью атомов углерода (m = 3-9), каждый из которых (кроме карбонильного углерода) связан с гидроксильной группой. Простейший из моносахаридов - глицериновый альдегид - содержит один асимметрический атом углерода и известен в виде двух оптических антиподов (D и L). Прочие моносахариды имеют несколько асимметрических атомов углерода; их рассматривают как производные D- или L-глицсринового альдегида и относят в соответствии с абсолютной
при (
т-1)-м атоме углерода к D- или L-pяду. Различия между моносахаридами в каждом ряду обусловлены относительной конфигурацией остальных асимметрических центров (см.
)
.Характерное свойство моносахаридов в растворах - способность к мутаротации, то есть установлению таутомерного равновесия (см.
) между ациклической альдегидо- или кетоформой, двумя пятичленными (фуранозными) и двумя шестичленными (пиранозными) циклическими полуацетальными формами (см. схему). Образующиеся пиранозы (как и фуранозы) различаются конфигурацией (a или b) возникающего при циклизации асимметрического центра у карбонильного атома углерода (на схеме помечен звёздочкой).
Соотношение между таутомерными формами в равновесии определяется их термодинамической устойчивостью (для обычных сахаров преобладают пиранозные формы). Полуацетальный гидроксил резко отличается от прочих гидроксильных групп моносахарида по способности к реакциям нуклеофильного замещения. Такие реакции с разнообразными спиртами приводят к образованию (остаток спирта в гликозиде называют агликоном). В тех случаях, когда агликоном служит молекула моносахарида, образуются олиго- и полисахариды. При этом каждый остаток моносахарида может иметь пиранозную или фуранозную структуру, a- или b-конфигурацию гликозидной связи и быть связанным с любой из гидроксильных групп соседнего моносахарида. Поэтому число различающихся строением полимерных молекул, которые можно построить даже только из одного моносахарида, огромно. К наиболее типичным моносахаридам относятся D - , D- , D- , D- , D- ,L- .К моносахаридам относятся также: дезоксисахара, в молекулах которых один или несколько гидроксилов заменены атомами водорода ( L- , L- ,2-дезокси-D-pибоза); аминосахара, в молекулах которых один или несколько гидроксилов заменены на аминогруппы (D-глюкозамин, D-галактозамин); многоатомные спирты, или альдиты, образующиеся при восстановлении карбонильных групп моносахаридов (сорбит, маннит); ,то есть моносахариды, у которых первичная спиртовая группа окислена до карбоксильной; разветвленные сахара, содержащие нелинейную цепь углеродных атомов (апиоза, L-cтрептоза); высшие сахара с длиной цепи более шести атомов углерода ( , ) .За исключением D-глюкозы и D-фруктозы, свободные моносахариды встречаются в природе редко. Обычно они входят в состав разнообразных гликозидов, олиго- и полисахаридов и могут быть получены из них кислотным гидролизом. Разработаны методы химического синтеза редких моносахаридов, исходя из более доступных. Олигосахариды содержат в своём составе 2-10 моносахаридов, связанных гликозидными связями. Наиболее распространены в природе дисахариды , , .Известны многочисленные гликозиды оли-госахаридов, к которым относятся различные физиологически активные вещества (например, ,сердечные гликозиды, ,многие антибиотики, ) . Полисахариды - высокомолекулярные, линейные или разветвленные соединения, молекулы которых построены из моносахаридов, связанных гликозидными связями. В состав полисахаридов могут входить также заместители неуглеводной природы (остатки фосфорной, серной и жирных кислот). В свою очередь цепи полисахаридов могут присоединяться к белкам с образованием .Отдельную группу составляют биополимеры, в молекулах которых остатки моно- или олигосахаридов соединены друг с другом не гликозидными, а фосфодиэфирными связями; к этой группе относятся тейхоевые кислоты из клеточных стенок грамположительных бактерий, некоторые полисахариды дрожжей, а также ,в основе которых лежит полирибозофосфатная (РНК) или поли-2-дезоксирибозофосфатная (ДНК) цепь. Физико-химические свойства углеводов.Благодаря обилию полярных (гидроксильных, карбонильной и др.) групп в молекулах моносахаридов они хорошо растворимы в воде и нерастворимы в неполярных органических растворителях (бензоле, петролейном эфире и др.). Способность к таутомерным превращениям обычно затрудняет кристаллизацию моносахаридов. Если такие превращения невозможны, как в гликозидах или олигосахаридах типа сахарозы, вещества кристаллизуются легко. Многие гликозиды с малополярными агликонами (например, сапонины) проявляют свойства поверхностно-активных соединений. Полисахариды являются гидрофильными полимерами, молекулы которых способны к ассоциации с образованием высоковязких растворов (растительной , ) ;при определённом соотношении свободных и ассоциированных участков молекул полисахариды дают прочные (агар, ) .В отдельных случаях молекулы полисахаридов образуют высокоупорядоченные надмолекулярные структуры, нерастворимые в воде ( , ) . Биологическая роль углеводов. Роль У. в живых организмах чрезвычайно многообразна. В растениях моносахариды являются первичными продуктами и служат исходными соединениями для биосинтеза разнообразных гликозидов, полисахаридов, а также веществ др. классов (аминокислот, жирных кислот, полифенолов и т.д.). Эти превращения осуществляются соответствующими ферментными системами, субстратами для которых служат, как правило, богатые энергией фосфорилированные производные сахаров, главным образом нуклеозиддифосфатсахара. У. запасаются в виде в высших растениях, в виде в животных, бактериях и грибах и служат энергетическим резервом для жизнедеятельности организма (см. , , ) .В виде гликозидов в растениях и животных осуществляется транспорт различных продуктов обмена веществ. Многочисленные полисахариды или более сложные углеводсодержащие полимеры выполняют в живых организмах опорные функции. Жёсткая клеточная стенка у высших растений построена из целлюлозы и гемицеллюлоз, у бактерий - из пептидогликана; в построении клеточной стенки грибов и наружного скелета членистоногих принимает участие хитин. В организме животных и человека опорные функции выполняют сульфатированные соединительной ткани, свойства которых позволяют обеспечить одновременно сохранение формы тела и подвижность отдельных его частей; эти полисахариды также способствуют поддержанию водного баланса и избирательной катионной проницаемости клеток. Аналогичные функции в морских многоклеточных водорослях выполняют сульфатированные галактаны (красные водоросли) или более сложные сульфатированные гетерополи-сахариды (бурые и зелёные водоросли); в растущих и сочных тканях высших растений аналогичную функцию выполняют пектиновые вещества. Особенно важную и до конца ещё не изученную роль играют сложные У. в образовании специфических клеточных поверхностей и мембран. Так, гликолипиды - важнейшие компоненты мембран нервных клеток, липополисахариды образуют наружную оболочку грамотрицательных бактерий. У. клеточных поверхностей часто определяют явление иммунологической специфичности, что строго доказано для групповых веществ крови и ряда бактериальных .Имеются данные, что углеводные структуры принимают участие также в таких высокоспецифичных явлениях клеточного взаимодействия, как оплодотворение, «узнавание» клеток при тканевой дифференциации и отторжении чужеродной ткани и т.д. Практическое значение углеводов.У. составляют большую (часто основную) часть пищевого рациона человека (см. ) .В связи с этим они широко используются в пищевой и кондитерской промышленности (крахмал, сахароза, пектиновые вещества, агар). Их превращения при спиртовом брожении лежат в основе процессов получения этилового спирта, пивоварения, хлебопечения; др. типы брожения позволяют получить глицерин, молочную, лимонную, глюконовую кислоты и др. вещества. Глюкоза, аскорбиновая кислота, сердечные гликозиды, углеводсодержащие антибиотики, гепарин широко применяются в медицине. Целлюлоза служит основой текстильной промышленности, получения искусственного целлюлозного волокна, бумаги, пластмасс (см. ) ,взрывчатых веществ (см. ) и др. Важнейшие вопросы химии и биохимии У.- усовершенствование методов установления строения и синтеза природных У., выяснение связи между их структурой и функцией в организме, а также путей биосинтеза - разрабатываются химическими и биохимическими научными центрами наряду с др. актуальными проблемами органической химии, биохимии и молекулярной биологии. Исследованиям только в области У. посвящены специализированные международные издания: ежегодник «Advances in Carbohydrate chemistry and biochemistry» (c 1945) и журнал «Carbohydrate research» (c 1965). см. также статьи , , , .
Лит.:Химия углеводов, М., 1967; Методы химии углеводов, пер. с англ., М., 1967; Гликопротеины [т. 1-2], пер. с англ., М., 1969; Carbohydrates, ed. by G. О. AspinalI, L. - Baltimore, [1973]; Industrial gums, eds. R. L. Whistler and J. N. Bemiller, 2 ed., N. Y. - L., 1973. А. И. Усов. 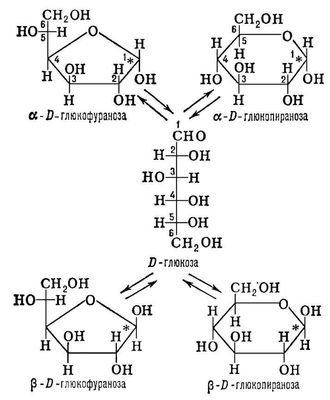
Рис. к ст. Углеводы. Углевоз Углево'з,угольщик, сухогрузное судно для перевозки каменного угля навалом; один из типов .Самоходные морские У. появились в середине 19 в. в связи с массовыми перевозками угля для нужд промышленности, энергетики и транспорта. У. - однопалубные суда с минимальным надводным бортом, машинное отделение и жилые помещения располагаются в корме. На У. предусматривают устройства для интенсивной вентиляции трюмов, оборудование для замера температуры воздуха в них, средства борьбы с пожарами, защиту помещений от газов, выделяемых грузом. Размеры грузовых люков и прочность корпусных конструкций рассчитывают на применение разгрузочных .У большинства морских У. (1976) грузоподъёмность 2-20 тыс. т,скорость 20-26 км/ч.На некоторых саморазгружающихся У. под трюмами в виде воронок располагаются продольные ленточные транспортёры, которые при разгрузке подают груз на палубный разгрузчик, а оттуда - на берег. Углегорск (город в Донецкой обл.) Углего'рск,город в Донецкой области УССР. Подчинён Енакиевскому горсовету. Железнодорожный узел (линии на Донецк - Никитовку, Дебальцево). 15 тыс. жителей (1975). Добыча угля. Центральная обогатительная фабрика. Предприятия пищевой промышленности. Углегорск (город в Сахалинской обл.) Углего'рск,город областного подчинения в Сахалинской области РСФСР. Порт на берегу Татарского пролива, в 150 кмк С. от железнодорожная станция Ильинск. 18,4 тыс. жителей (1975). Леспромхоз, целлюлозно-бумажный комбинат, цех фирмы «Сахалинмебель», завод «Стройдеталь». Предприятия пищевой промышленности. Близ У. - добыча каменного угля. Углегорская ГРЭС Углего'рская ГРЭС,конденсационная электростанция в посёлке Светлодарское Донецкой области УССР. Проектная мощность 3600 Мвт(4 блока по 300 и 3 по 800 Мвт) .Топливом служат донецкий уголь для блоков 300 Мвти мазут для блоков 800 Мвт.Техническое водоснабжение оборотное на базе наливного водохранилища. Строительство начато в 1967, 1-я очередь пущена в 1973. На начало 1976 введены в эксплуатацию 4 блока по 300 Мвти 1 блок 800 Мвт.Электроэнергия передаётся по высоковольтным линиям электропередачи напряжением 110 и 330 кв.Станция входит в объединённую энергосистему Юга и через неё в Единую энергетическую систему СССР. Углегорский Углего'рский,посёлок городского типа в Тацинском районе Ростовской области РСФСР. Расположен в 6 кмот железнодорожной станции Тацинская (на линии Волгоград - Лихая). Обувная фабрика, завод металлоизделий. Углезаводск Углезаво'дск,посёлок городского типа в Долининском районе Сахалинской области РСФСР. Расположен в южной части острова Сахалин, на р. Наиба. Железнодорожная станция на ветке Быков - Сокол. Завод железобетонных изделий. Вблизи У. - добыча каменного угля. Углекаменск Углека'менск,посёлок городского типа в Приморском крае РСФСР, подчинён Партизанскому горсовету. Расположен в 15 кмк С.-В. от Партизанска и в 4 кмот железнодорожной станции Лейтенант Гордеев (на ветке Партизанск - Сергеевка). Добыча каменного угля. Швейная фабрика. Углекислота Углекислота',неправильное название CO 2, которая является ангидридом угольной кислоты. Углекислые соли Углеки'слые со'ли,соли угольной кислоты; см. , . Углекислый газ Углеки'слый газ,CO 2, то же, что . Угленосность Углено'сность,совокупность данных о количестве пластов угля (общем и удовлетворяющих кондициям), ,распределении пластов по разрезу угленосной толщи, их синонимике, мощности, строении и степени выдержанности каждого из них, петрографических типах, химико-технологических свойствах углей и закономерностей пространственного их изменения в связи с условиями образования угленосных формаций. См. также , . Углепетрография Углепетрогра'фия,описание составных частей угля, изучаемых макроскопически и под микроскопом в тонких и полированных шлифах. Основоположниками У. в СССР являются Ю. А. Жемчужников, М. Д. Залесский; за рубежом - Р. Тиссен (США), М. Стопе (Великобритания). С совершенствованием методов и расширением круга проблем У. она превратилась в науку о составе, строении и происхождении углей - петрологию углей. Основная задача петрологии углей - изучение элементарных компонентов органического вещества угольных пластов, то есть остатков растений, которые в процессе биохимического разложения в торфяную стадию углеобразования в той или иной мере сохранили или утратили свою форму и структуру. При этом различают форменные элементы и основную массу, которые совместно называются составными частями, или компонентами, угля. Различают макрокомпоненты ( ,фюзен) и микрокомпоненты (споры, кутикула и т.д.). В У. используются оптические методы микроскопических исследований с применением проходящего и отражённого, простого, поляризованного и ультрафиолетового света в воздушной среде и с иммерсией; разделение в тяжёлых жидкостях (смеси C 6H 6, CCl 4, CHBr 3и др.) на группы компонентов, близких по плотности; методы мацерации для выделения и последующего изучения устойчивых компонентов, методы травления сильными окислителями для выявления скрытой структуры угля, а также методы термического и химического анализа вещества компонентов или их групп, выделенных из общей массы угля. Большое значение для решения задач имеют количественные методы: определение отражательной способности, показателя преломления и твёрдости витринита, цвета и яркости люминесценции лейптинита, подсчёт содержания компонентов в средних пластовых пробах и в кусках угля. Различными исследователями выделяется от 14 до 40 петрографических компонентов углей, объединяемых по исходному материалу и условиям его превращения в торфяной стадии углеобразования в три основные (витринитовые или гелинитовые, фюзинитовые и лейптинитовые) и две промежуточные (слабо гелифицированные и слабо фюзенизированные) группы микрокомпонентов. Количественное соотношение микрокомпонентов и состав исходных растений определяют генетические типы углей, характеризующиеся определёнными химическими и технологическими свойствами в пределах каждой данной стадии углефикации. Лит.:Петрографические особенности и свойства углей, М., 1963; Материалы по геологии и петрографии углей СССР, Л., 1968; Угленосные формации и их генезис, М., 1973; Петрология палеозойских углей СССР, М., 1975. Углеплотность Углепло'тность,количество запасов угля, отнесённое к единице угленосной площади (месторождения, района, бассейна). У. определяется путём деления запасов угля, подсчитанных до той или иной глубины (перспективной для промышленного освоения), на общую площадь, по которой они оценены в млн. т/км 2.У. используется при подсчёте прогнозных запасов углей с переносом величин указанных выше показателей с хорошо разведанных площадей на слабо изученные, а также для сравнительной характеристики промышленной значимости изученных угленосных площадей. Углерод Углеро'д(латинское Carboneum), С, химический элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. Известны два стабильных изотопа: 12C (98,892%) и 13C (1,108%). Из радиоактивных изотопов наиболее важен 14C с периодом полураспада (Т = 5,6Ч10 3лет). Небольшие количества 14C (около 2Ч10 -10% по массе) постоянно образуются в верхних слоях атмосферы при действии нейтронов космического излучения на изотоп азота 14N. По удельной активности изотопа 14C в остатках биогенного происхождения определяют их возраст. 14C широко используется в качестве . Историческая справка. У. известен с глубокой древности. Древесный уголь служил для восстановления металлов из руд, алмаз - как драгоценный камень. Значительно позднее стали применять графит для изготовления тиглей и карандашей. В 1778 К. ,нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется углекислый газ. Химический состав алмаза был установлен в результате опытов А. (1772) по изучению горения алмаза на воздухе и исследований С. (1797), доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. У. был признан химическим элементом в 1789 Лавуазье. Латинское название carboneum У. получил от carbo - уголь. Распространение в природе. Среднее содержание У. в земной коре 2,3Ч10 -2% по массе (1Ч10 -2в ультраосновных, 1Ч10 -2- в основных, 2Ч10 -2- в средних, 3Ч10 -2 - вкислых горных породах). У. накапливается в верхней части земной коры (биосфере): в живом веществе 18% У., древесине 50%, каменном угле 80%, нефти 85%, антраците 96%. Значительная часть У. литосферы сосредоточена в известняках и доломитах. Число собственных минералов У. - 112; исключительно велико число органических соединений У. - углеводородов и их производных. С накоплением У. в земной коре связано накопление и многих др. элементов, сорбируемых органическим веществом и осаждающихся в виде нерастворимых карбонатов, и т.д. Большую геохимическую роль в земной коре играют CO 2и угольная кислота. Огромное количество CO 2выделяется при вулканизме - в истории Земли это был основной источник У. для биосферы. По сравнению со средним содержанием в земной коре человечество в исключительно больших количествах извлекает У. из недр (уголь, нефть, природный газ), так как эти ископаемые - основной источник энергии. Огромное геохимическое значение имеет круговорот У. (см. ниже раздел Углерод в организме и ст. ) . У. широко распространён также в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода. Физико и химические свойства. Известны четыре кристаллические модификации У.: графит, алмаз, карбин и лонсдейлит. Графит - серо-чёрная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. Построен из кристаллов гексагональной структуры: а=2,462Е, c=6,701Е. При комнатной температуре и нормальном давлении (0,1 Мн/м 2,или 1 кгс/см 2) графит термодинамически стабилен. Алмаз - очень твёрдое, кристаллическое вещество. Кристаллы имеют кубическую гранецентрированную решётку: а =3,560 Е. При комнатной температуре и нормальном давлении алмаз метастабилен (подробно о структуре и свойствах алмаза и графита см. в соответствующих статьях). Заметное превращение алмаза в графит наблюдается при температурах выше 1400 °С в вакууме или в инертной атмосфере. При атмосферном давлении и температуре около 3700 °С графит возгоняется. Жидкий У. может быть получен при давлениях выше 10,5 Мн/м 2(105 кгс/см 2) и температурах выше 3700 °С. Для твёрдого У. ( , , ) характерно также состояние с неупорядоченной структурой - так называемый «аморфный» У., который не представляет собой самостоятельной модификации; в основе его строения лежит структура мелкокристаллического графита. Нагревание некоторых разновидностей «аморфного» У. выше 1500-1600 °С без доступа воздуха вызывает их превращение в графит. Физические свойства «аморфного» У. очень сильно зависят от дисперсности частиц и наличия примесей. Плотность, теплоёмкость, теплопроводность и электропроводность «аморфного» У. всегда выше, чем графита. Карбин получен искусственно. Он представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см 3) .Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлит найден в метеоритах и получен искусственно; его структура и свойства окончательно не установлены. Конфигурация внешней электронной оболочки атома У. 2s 22p 2.Для У. характерно образование четырёх ковалентных связей, обусловленное возбуждением внешней электронной оболочки до состояния 2 sp 3.Поэтому У. способен в равной степени как притягивать, так и отдавать электроны. Химическая связь может осуществляться за счёт sp 3-, sp 2-и sp-гибридных орбиталей, которым соответствуют координационные числа 4, 3 и 2. Число валентных электронов У. и число валентных орбиталей одинаково; это одна из причин устойчивости связи между атомами У. Уникальная способность атомов У. соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений У., изучаемых . В соединениях У. проявляет степени окисления -4; +2; +4. Атомный радиус 0,77Е, ковалентные радиусы 0,77Е, 0,67Е, 0,60Е соответственно в одинарной, двойной и тройной связях; ионный радиус C 4-2,60Е, C 4+0,20Е. При обычных условиях У. химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства. Химическая активность убывает в ряду: «аморфный» У., графит, алмаз; взаимодействие с кислородом воздуха (горение) происходит соответственно при температурах выше 300-500 °С, 600-700 °С и 850-1000 °С с образованием двуокиси углерода CO 2и окиси углерода CO. CO 2растворяется в воде с образованием .В 1906 О. получил недоокись У. C 3O 2. Все формы У. устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентрированных HNO 3и KClO 3и др.). «Аморфный» У. реагирует с фтором при комнатной температуре, графит и алмаз - при нагревании. Непосредственное соединение У. с хлором происходит в электрической дуге; с бромом и иодом У. не реагирует, поэтому многочисленные синтезируют косвенным путём. Из оксигалогенидов общей формулы COX 2(где Х - галоген) наиболее известна хлорокись COCl 2( ) .Водород с алмазом не взаимодействует; с графитом и «аморфным» У. реагирует при высоких температурах в присутствии катализаторов (Ni, Pt): при 600-1000 °С образуется в основном метан CH 4, при 1500- 2000 °С - ацетилен C 2H 2 ,в продуктах могут присутствовать также др. углеводороды, например этан C 2H 6 ,бензол C 6H 6. Взаимодействие серы с «аморфным» У. и графитом начинается при 700-800 °С, с алмазом при 900-1000 °С; во всех случаях образуется сероуглерод CS 2. Др. соединения У., содержащие серу (тиоокись CS, тионедоокись C 3S 2, сероокись COS и тиофосген CSCl 2), получают косвенным путём. При взаимодействии CS 2с сульфидами металлов образуются тиокарбонаты - соли слабой тиоугольной кислоты. Взаимодействие У. с азотом с получением циана (CN) 2происходит при пропускании электрического разряда между угольными электродами в атмосфере азота. Среди азотсодержащих соединений У. важное практическое значение имеют цианистый водород HCN (см. ) и его многочисленные производные: цианиды, гало-генцианы, нитрилы и др. При температурах выше 1000 °С У. взаимодействует со многими металлами, давая .Все формы У. при нагревании восстанавливают окислы металлов с образованием свободных металлов (Zn, Cd, Cu, Pb и др.) или карбидов (CaC 2, Mo 2C, WO, TaC и др.). У. реагирует при температурах выше 600- 800 °С с водяным паром и углекислым газом (см. ) .Отличительной особенностью графита является способность при умеренном нагревании до 300-400 °С взаимодействовать со щелочными металлами и галогенидами с образованием типа C 8Me, C 24Me, C 8X (где Х - галоген, Me - металл). Известны соединения включения графита с HNO 3, H 2SO 4, FeCl 3и др. (например, бисульфат графита C 24SO 4H 2). Все формы У. нерастворимы в обычных неорганических и органических растворителях, но растворяются в некоторых расплавленных металлах (например, Fe, Ni, Co). Народнохозяйственное значение У. определяется тем, что свыше 90% всех первичных источников потребляемой в мире энергии приходится на органическое ,главенствующая роль которого сохранится и на ближайшие десятилетия, несмотря на интенсивное развитие ядерной энергетики. Только около 10% добываемого топлива используется в качестве сырья для и ,для получения и др. О получении и применении У. и его соединений см. также , , , , , , , . Б. А. Поповкин. У. в организме. У. - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности ( ,а также многочисленные низкомолекулярные биологически активные вещества - витамины, гормоны, медиаторы и др.). Значительная часть необходимой организмам энергии образуется в клетках за счёт окисления У. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений (см. ) . Уникальная роль У. в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один др. элемент периодической системы. Между атомами У., а также между У. и др. элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность У. образовывать 4 равнозначные валентные связи с др. атомами У. создаёт возможность для построения углеродных скелетов различных типов - линейных, разветвленных, циклических. Показательно, что всего три элемента - С, О и Н - составляют 98% общей массы живых организмов. Этим достигается определённая экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет намного сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома У. лежат в основе различных видов органических соединений (способность к оптической изомерии оказалась решающей в биохимической эволюции аминокислот, углеводов и некоторых алкалоидов). Согласно общепринятой гипотезе А. И. ,первые органические соединения на Земле имели абиогенное происхождение. Источниками У. служили метан (CH 4) и цианистый водород (HCN), содержавшиеся в первичной атмосфере Земли. С возникновением жизни единственным источником неорганического У., за счёт которого образуется всё органическое вещество биосферы, является (CO 2), находящаяся в атмосфере, а также растворённая в природных водах в виде HCO - 3. Наиболее мощный механизм усвоения (ассимиляции) У. (в форме CO 2) - -осуществляется повсеместно зелёными растениями (ежегодно ассимилируется около 100 млрд. 1, 2, 3, 4, 5, 6, 7, 8 |
|||||||
