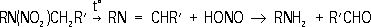|
|
Популярные авторы:: БСЭ :: Андерсон Пол Уильям :: Андреев Леонид Николаевич :: Говард Роберт Ирвин :: Твен Марк :: Биленкин Дмитрий Александрович :: Чапек Карел :: Куприн Александр Иванович :: Дансени Лорд :: Желязны Роджер Популярные книги:: Справочник по реестру Windows XP :: Пичугин мост :: Бурый волк :: Маски :: Мясоеды :: Падение Эдварда Барнарда :: Затишье :: Шакир :: Подозрение :: Чайная роза |
Большая Советская Энциклопедия (НИ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (НИ) - Чтение (стр. 27)
Несмотря на стремление Н. истолковывать свою философию как «подлинно восточную», исходящую из буддизма, его взгляды близки в сущности западно-европейской идеалистической философии 20 в., прежде всего
. Согласно основной философской концепции Н., названной им «антиинтеллектуалистической», истинное бытие достигается интуитивно благодаря особому «способу рассмотрения вещей» или «способу осознания себя», позволяющему якобы преодолеть противоположность объективного и субъективного. Общественное развитие Н. представляет как результат взаимодействия общего - небытия и отдельного - человеческих индивидов, подлинность отношения которых выражается в коммуникации между «Я» и «Ты».
Соч.: Дзэнсю (Полн. собр. соч.), т. 1-18, Токио, 1947-53. Лит.:Козловский Ю. Б., Концепция восточной культуры Нисида Китаро, «Вестник истории мировой культуры», 1961, № 2; его же, Распространение экзистенциализма в Японии, в кн.: Современный экзистенциализм, М., 1966; Тосака Дзюн, Сэнсю, Дайрокукан (Избр. произв.), 6 изд., Токио, 1948; Кояма Ивао, Нисида тэцугаку (Философия Нисида), Токио, 1955; Нагао Мититака, Нисида тэцугаку но кайсяку (Комментарии к философии Нисида), Токио, 1960. Ю. Б. Козловский. Нисиномия Нисино'мия, город в Японии, на Ю. острова Хонсю, в префектуре Хиого. 378 тыс. жителей (1971). Важный транспортный узел. Промышленный пригород Осаки. Текстильная и пищевая (крупнейший центр производства лучших сортов сакэ) промышленность, заводы оптического и точного приборостроения, авиационный. Ниспорены Ниспоре'ны, посёлок городского типа, центр Ниспоренского района Молдавской ССР, в 36 кмот ж.-д. станции Быковец (на линии Унгены - Кишинев). 11,8 тыс. жителей (1974). Предприятия пищевой промышленности, кирпичный завод. Ниссан Ни'ссан(Nissan), река на Ю. Швеции. Длина 206 км, площадь бассейна около 2,7 тыс. км 2. Берёт начало на возвышенности Смоланд, протекает через ряд озёр, образует пороги и водопады. Впадает в пролив Каттегат. ГЭС. В устье - морской порт Хальмстад. «Ниссан Мотор» «Ни'ссан Мо'тор»(Nissan Motor, Япония), см. в ст. . Нисский Георгий Григорьевич Ни'сскийГеоргий Григорьевич [р. 8(21).1.1903, станция Новобелицкая, ныне Гомельской области БССР], советский живописец, народный художник РСФСР (1965), действительный член АХ СССР (1958). Учился в московском Вхутемасе - Вхутеине (1922-30). Испытал влияние А. А. ; был близок к («Осень. Семафоры», 1932, Третьяковская галерея). Стремясь передать мощь новой, преобразованной социализмом действительности, а также восприятие природы современным человеком, привыкшим к стремительному ритму жизни, Н. вносит в свои произведения (преимущественно марины и индустриальные пейзажи) сильное динамическое начало, охватывает обширные пространства, а с середины 50-х гг. всё чаще прибегает к декоративно-обобщённой манере письма, строя композиции с помощью остро ритмизованных силуэтов и крупных цветовых плоскостей, насыщенных, порой локальных по тону. Произведения: «У берегов Дальнего Востока» (МГУ), «Пейзаж с маяком» (Львовская картинная галерея), «Порт Одесса» (теплоход «Россия») - все три 1950, Государственная премия СССР, 1951; «Подмосковная зима» (1951, Челябинская городская картинная галерея); «Колхоз “Загорье”» (1959), «Над снегами» (1959-60) - оба в Русском музее, Ленинград. Награжден орденом Трудового Красного Знамени, а также медалями. Лит.:Киселев М. Ф., Г. Нисский, М., 1972. 
Г. Г. Нисский. «Подмосковная рокада». 1957. Львовская картинная галерея. Ниссля вещество Ни'ссля вещество', тигроид, тельца Ниссля, уплотнения цитоплазмы нервной клетки; описаны в конце 19 в. немецким учёным Ф. Нисслем (F. Nissl). В оптическом микроскопе (после окрашивания метиленовым синим и др. основными красителями) Н. в. имеет вид округлых телец, занимающих всё тело клетки и основания её отростков, в электронном микроскопе - скоплений и цистерн . Н. в. состоит из рибонуклеиновой кислоты (РНК), белков, кислых полисахаридов, липидов; активно участвует в синтезе белков клетки. Изменения химического состава, формы и окрашиваемости Н. в. происходят при травме нервной системы, воспалительных и инфекционных заболеваниях, отравлении ядами, кислородном голодании, функциональных сдвигах нейронов. Лит.:Питерс А., Палей С., Уэбстер Г., Ультраструктура нервной системы, пер. с англ., М., 1972. Нистагм Ниста'гм(от греч. nystagmуs - дремота), непроизвольные быстрые ритмические движения глазных яблок. Чаще встречается двусторонний Н., значительно реже - односторонний. В зависимости от направления колебаний глазных яблок выделяют Н. горизонтальный, вращательный (ротаторный), вертикальный и диагональный. Н. может быть у здоровых людей, например при вращении на кресле (вращательный Н.), при фиксации взора на движущихся предметах (оптокинетический Н.), при вливании в ухо холодной или тёплой воды (т. н. калорический Н.) и т.д. Как патологическое состояние Н. возникает при поражении вестибулярного аппарата, в частности лабиринта, преддверно-улиткового нерва, вестибулярных ядер мозгового ствола. Н. возможен при расположении патологического процесса в мозжечке; появление Н. может быть также обусловлено воспалительными процессами внутреннего уха, черепно-мозговой травмой, инфекционными и токсическими поражениями мозга, его новообразованиями. В более редких случаях Н. образуется вследствие болезни глаз. Известен и профессиональный Н., возникающий у горнорабочих при работе кайлом в шахтах с плохим освещением и вентиляцией; у этих рабочих перенапрягаются некоторые мышцы глаз в связи с тем, что они постоянно направляют глаза кверху и в сторону. Лечение состоит в устранении основного заболевания. При Н. горнорабочих - перевод больных на работу в наземных условиях. Лит.:Циммерман Г. С., Клиническая отоневрология, М., 1952. В. А. Карлов. Нистатин Нистати'н, лекарственный противогрибковый препарат из группы . Применяют в таблетках для лечения и профилактики , выпускают также нистатиновую мазь для наружного применения. Нистер дер Ни'стердер (псевдоним; настоящее имя и фамилия Пинхос Менделевич Каганович) [20.10(1.11).1884 - 4.6.1950], еврейский советский писатель. Родился в Бердичеве. Учился в хедере. В 1907 опубликована книга стихов в прозе «Думы и мотивы». По форме дореволюционные стихи и проза Н. тяготели к модернистским течениям, но содержание его творчества было демократическим. В 1922-25 жил в Берлине, печатался в европейских советских журналах. В изданных в 1929 сборниках рассказов «Из моих владений» и «Воображение» проявилось символистское восприятие революционной действительности. Переходным произведением на пути к реализму была книга очерков «Три столицы» (1934). Социально-исторический роман «Семья Машбер» (ч. 1-2, 1939-43) изображает жизнь евреев в России в последней трети 19 в. К реалистическим произведениям Н. принадлежит и неоконченный роман «О 1905 годе» (опубликован в 1964). Лит.:Гурштейн А., Избранные статьи, М., 1959; Львовский Я., Ин тогтеглехн лебн, «Советиш геймланд», 1964, №6. Г. А. Ременик. «Нистру» «Ни'стру»(«Днестр»), ежемесячный литературно-художественный и общественно-политический журнал на молдавском языке. Орган СП Молдавской ССР. Издаётся с 1932 в Кишиневе; до 1957 носил название «Октомбрие» («Октябрь»). Тираж (1974) около 6 тыс. экземпляров. Нисходящий узел орбиты Нисходя'щий у'зел орби'ты, см. . Нит Нит(от лат. niteo - блещу, сверкаю), наименование единицы яркости, входящей в (СИ), - канделына м 2, принятое Международной комиссией по освещению (1951), а также ГОСТ 7932-56 «Световые единицы», но не утвержденное . Обозначения: русское нт, международное nt. 1 нт= 10 -4 кд/см 2= 9,95 · 10 -5 = 3,13 · 10 -4 . Наименование Н. в новые стандарты на единицы не включается. Нитард Ни'тард(Nithardus), Нитгард (умер 14.6.844), франкский историк. Внук Карла Великого. В сочинении «Четыре книги истории» (доведено до 843) описал борьбу между сыновьями Карлом Лысым, Людовиком Немецким и Лотарем, в которой участвовал на стороне Карла Лысого. Осуждал междоусобицы, отстаивал необходимость централизации. Книга содержит уникальные сведения о 841-843, текст на романском и германском языке «Страсбургской клятвы» 842 - первого дошедшего до нас памятника на этих языках. Соч. в кн.: Quellen zur Karolingischen Reichsgeschichte, Bd I, B., 1955. Нитевидные кристаллы
Нитеви'дные криста'ллы, «усы»,
в форме иголок и волокон, имеющие диаметр от нескольких
нм(десятков
Первые упоминания об искусственном получении Н. к. относятся к 16 в. Особенный интерес к Н. к. возник в 50-х гг. 20 в. - после того как было обнаружено, что Н. к. многих веществ обладают необычно высокими механическими свойствами. В последующие годы в лабораториях ряда стран получены Н. к. более 140 различных элементов и соединений. Н. к. некоторых тугоплавких соединений (карбида кремния, окиси алюминия, нитрида кремния и др.) выпускаются в промышленных масштабах. Наиболее важное свойство Н. к. - уникально высокая прочность (близкая к теоретической, которую можно оценить из значений модуля упругости материала), в несколько раз превосходящая прочность массивных моно- и поликристаллов ( рис. 1). Высокая прочность Н. к. объясняется совершенством их структуры и значительно меньшим, чем у массивных кристаллов, количеством (а иногда полным отсутствием) объёмных и поверхностных дефектов (одна из важнейших причин малой дефектности Н. к. - их малые размеры, при которых вероятность присутствия дефекта в каждом из кристаллов невелика). Н. к. тугоплавких соединений, помимо высокой температуры плавления и прочности, имеют высокий модуль упругости, химически инертны по отношению ко многим металлическим, полимерным и керамическим материалам до весьма высоких температур. В Н. к., в отличие от поликристаллических волокон, не могут идти процессы , обычно вызывающие резкое падение прочности при высоких температурах. Известно большое число методов получения Н. к.: физическое испарение с последующей конденсацией, осаждение из газовой фазы при участии химических реакций, из растворов, направленная кристаллизация эвтектических сплавов, выращивание на пористых мембранах и др. Н. к. тугоплавких металлов и соединений обычно получают методом осаждения из газовой фазы в высокотемпературных печах периодического, полунепрерывного или непрерывного действия. На рис. 2 показаны возможные схемы роста Н. к. Наиболее важные направления в применении Н. к. - реализация их высоких прочностных свойств в , а также использование их высокой тепловой и абразивной стойкости. Лит.:Бережкова Г. В., Нитевидные кристаллы М., 1969; Монокристальные волокна и армированные ими материалы, пер. с англ., М., 1973. В. Н. Грибков, К. И. Портной. 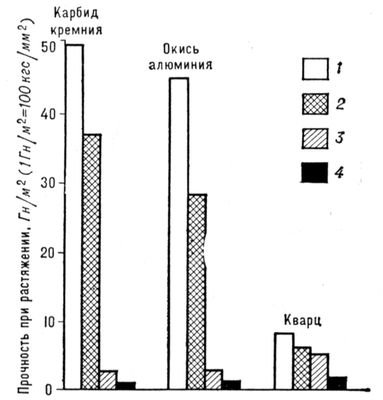
Рис. 1. Прочность нитевидных кристаллов в сравнении с теоретической и реальной прочностью некоторых материалов: 1 - теоретическая (s » 0,1 Е, где Е- модуль упругости); 2 - нитевидные кристаллы; 3 - непрерывные волокна; 4 - массивные образцы. 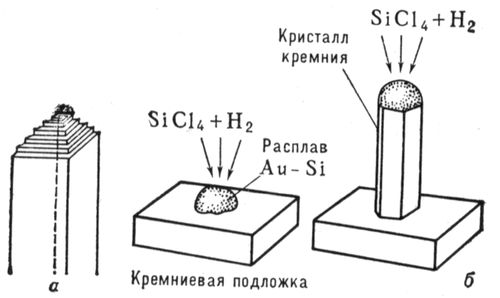
Рис. 2. Схемы роста нитевидного кристалла из газовой фазы по дислокационному механизму (а) и механизму пар - жидкость - твёрдая фаза (б). Нитеводитель Нитеводи'тель,нитевод, один из основных рабочих органов вязальной машины любого типа. Н. служит для прокладывания нити на иглы машины в процессе петлеобразования (см. ). Нить, проходящая сквозь Н., подаётся на иглы под определенным углом, при небольшом постоянном натяжении. Различают Н. подвижные и неподвижные. Подвижный Н. совершает возвратно-поступательное движение (на плоских машинах) или круговое (на круглых машинах) относительно неподвижной игольницы и прокладывает нить на работающие иглы. К подвижным Н. относятся также нитеводы (ушковины) основовязальных машин. Такие Н. совершают продольные и качательные движения, обвивая нитями иглы. Неподвижные Н. прокладывают нити на иглы движущейся игольницы. Многие вязальные машины имеют несколько (2-6) Н. в каждой петлеобразующей системе. При вязании некоторых изделий, например чулок или рисунчатого трикотажа, используют автоматически попеременно действующие Н., заменяемые специальным механизмом. Нителла Ните'лла(Nitella), род харовых водорослей. Около 100 видов; в СССР - 14. Высота растений до 1 м.Основные побеги и ветви состоят из длинных (до 25 см), одноклеточных междоузлий и многоклеточных узлов. Боковые побеги вильчатые, расположены мутовками (по кругу) в узлах. Размножение половое и вегетативное - обрывками ветвей. Растет в озёрах и опреснённых участках морей. Многие виды Н. используют для изучения внутриклеточных процессов. Нитерой Нитеро'й(Niterуi), город на Ю.-В. Бразилии, у входа в бухту Гуанабара, на её восточном берегу (на западном берегу - г. Рио-де-Жанейро), административный центр штата Рио-де-Жанейро. 324,4 тыс. жителей (1970, с пригородами). Ж.-д. станция. Паромное сообщение с Рио-де-Жанейро. Машино-строительная, химическая и пищевая промышленность. Основан в 17 в. Нитки Ни'тки, , вырабатываемые из хлопчато-бумажной, шерстяной, льняной пряжи, натурального шёлка, химических волокон. В зависимости от назначения различают Н.: швейные, вышивальные, вязальные и штопку. Н. бывают белые, чёрные и цветные, матовой и глянцевой отделки, а также неотделанные - суровые. В зависимости от толщины Н. делят по торговым номерам: чем тоньше Н., тем выше их номер (например, хлопчато-бумажные Н. имеют номера от 80 до 10). Нитр Нитр..., нитро... (от греч. nнtron, лат. nitrum, первоначально - природная сода, начиная с 8 в. н. э. - селитра), в химических, биологических и др. терминах составная часть, означающая отношение к азоту (новолат. nitrogenium); см., например, , . Нитра (город в Чехословакии) Ни'тра(Nitra), город в Чехословакии, в Словацкой Социалистической Республике, в Западно-Словацкой области, на р. Нитра. 47 тыс. жителей (1971). Пищевая промышленность, машиностроение. С.-х. и педагогические институты. Н. - один из древнейших словацких городов. В начале железного века (800-500 до н. э.) на месте Н. находилось большое поселение, обнесённое валом. С приходом (6-7 вв.) в Подунавье славян Н. становится важным политическим и культурным центром Словакии. В 9 в. столица Нитранского княжества; построена древнейшая церковь, возникла первая церковная епархия. В это время Н. состояла из 2 мощных укреплений, обнесённых двойными валами и палисадами. В начале 10 в., после нашествия мадьяр, Н. стала удельным княжеством, а после освобождения от мадьяр в 13 в. и восстановления епархии Н. долгое время находилась во владении последней. Систематические раскопки ведутся с 1949. Лит.:Nitra, Nitra, [I960]. Нитра (река в Чехословакии) Ни'тра(Nitra), река в Чехословакии, левый приток р. Ваг (бассейн Дуная). Длина 242 км, площадь бассейна 5,2 тыс. км 2. Истоки на южных склонах хребта Малая Фатра (Западные Карпаты), нижнее течение на Среднедунайской равнине. Средний расход воды в нижнем течении около 25 м 3 /сек. Весеннее половодье, летняя межень. Сплав леса. На Н. - г. Нитра. Нитрагин Нитраги'н, для бобовых культур, содержащее клубеньковые бактерии, способные усваивать атмосферный азот и превращать его в доступные растениям соединения. Нитраллой Нитралло'й(от и англ. alloy - примесь, сплав), общее название группы конструкционных сталей, предназначенных для изготовления азотируемых деталей (см. ). Основные легирующие элементы в Н. - Al, Cr, Mo, V, которые образуют мелкокристаллические твёрдые , придающие поверхностному азотированному слою большую твёрдость (HV до 1200) и износостойкость. Наиболее типичные Н. - распространённые в СССР стали 38ХМЮА и 38ХЮ. Сталь 38ХМЮА, применяемая для изготовления ответственных деталей, наряду с Al и Cr, содержит Mo (0,15-0,25%), который увеличивает прокаливаемость, несколько повышает предел прочности сердцевины детали и предотвращает развитие отпускной хрупкости стали в процессе азотирования. Нитрамины Нитрами'ны, N-нитроаминосоединения, органические соединения, в молекулах которых группа - NO 2связана с атомом азота. Н. могут быть первичными RNHNO 2и вторичными RR'NNO 2(где R, R' - алкил или арил). Моноалкилнитрамины получают нитрованием N-ацилпроизводных первичных аминов (1) или дихлораминов (2) , например: CH 3NHCO 2CH 3® CH 3N (NO 2) CO 2CH 3® CH 3NHNO 2(1)
Вторичные алифатические Н. образуются при обработке соответствующего аминосоединения смесью азотной кислоты и уксусного ангидрида, борфторидом нитрония и др. Арилнитрамины синтезируют прямым нитрованием соответствующих аминов или окислением солей диазотатов. Ароматические Н., как правило, - твёрдые вещества, алифатические Н. - жидкости или низкоплавкие твёрдые вещества. Под действием кислот первичные алифатические Н. разлагаются на соответствующие спирты и закись азота, вторичные устойчивы к действию кислот даже при 100 °С; ароматические Н. подвергаются различным перегруппировкам. При взаимодействии со щелочами большинство первичных Н. дают соли; вторичные алифатические Н., имеющие a-водородные атомы, могут разлагаться на амины и альдегиды:
Низшие Н. чрезвычайно взрывоопасны. Некоторые Н. применяют в качестве бризантных , например тринитрофенилметилнитрамин ( ), циклотриметилентринитрамин ( ), циклотетраметилентетранитрамин ( ). Лит.:Химия нитро- и нитрозогрупп, под ред. Г. Фойера, пер. с англ., М., 1972; Овербергер Ч. Дж., Анселм Ж.-П., Ломбардино Дж., Органические соединения со связями азот-азот, пер. с англ., Л., 1970. М. М. Краюшкин. Нитраты Нитра'тыметаллов, соли азотной кислоты HNO 3. Бесцветные кристаллические вещества; при обычной температуре устойчивы; при высоких температурах легко отдают кислород и являются в этих условиях сильными окислителями (например, 2К NO 3= 2KNO 2+ O 2). Все Н. металлов хорошо растворимы в воде. В нейтральных и слабокислых растворах Н. получают действием НNO 3на металлы, окислы, некоторые соли, по реакциям обмена, действием NO 2на основания (наряду с нитритами) и др. Н. некоторых элементов (Na, К, Ca) встречаются в природе; из них практическое значение имеют только месторождения NaNO 3(чилийская селитра). Н. широко применяют как удобрения (соли Na, К, NH 4, Ca), в производстве (соли NH 4, Ba), как протраву при крашении (соли Cr, Fe, A1, Cu) и т.д. Н. аммония, щелочных и щелочноземельных металлов называются также . Нитраты природные Нитра'ты приро'дные,класс минералов, представляющих собой природные соли азотной кислоты. Главные минералы Н. п.: натриевая селитра NaNO 3; калиевая селитра КNO 3; аммонийная селитра NH 4NO 3; дарапскит Na 3(NO 3) · (SO 4) · Н 2О; нитромагнезит Mg (NO 3) 2· 6H 2O; нитрокальцит Ca (NO 3) 2· 4H 2O; нитробарит Ba (NO 3) 2; герхардтит Cu 2(NO 3)(OH) 3; ликазит Cu 6(NO 3) 2· (РО 4)(ОН) 7, буттгенбахит Cu 19(NO 3) 2· (OH) 32Cl 4· 3H 2O. Структура Н. п. напоминает структуру , но менее устойчива вследствие высокой степени поляризации кислорода под действием пятивалентного азота. Встречаются в виде солеобразных масс, выцветов, корочек, налётов. Все селитры хорошо растворяются в воде, обладают охлаждающим вкусом. Значительные месторождения находятся в Чили (провинции Тарапака и Антофагаста), где Н. п. ассоциируют с галогенидами, сульфатами, селенатами и некоторыми иодатами. В этих месторождениях калиевая и натриевая селитра составляют основная часть запасов. Щелочные Н. п. часто формируются при взаимодействии азотистых органических веществ и щелочных солей (например, налёты калиевой и натриевой селитры в полостях и трещинах пород или высыпки). На современном этапе Н.п. добываются в ограниченном количестве (1974); главную массу азотных соединений получают химическим путём (синтез аммиака из азота воздуха и водорода). Лит.:Костов И., Минералогия, пер. с англ., М., 1971. М. Д. Дорфман. Нитраты целлюлозы Нитра'ты целлюло'зы,нитроцеллюлоза, азотнокислые сложные эфиры общей формулы [С бН 7О 2(ОН) 3-х(ONO 2) x] n, где хможет меняться от 1 до 3; белая волокнистая рыхлая масса, очень напоминающая целлюлозу. Важнейшая характеристика Н. ц. - степень замещения или содержание азота, в значительной степени определяющие физико-механические, химические и технологические свойства этого полимера. Практическое применение имеют следующие основные виды Н. ц. (в скобках указано содержание азота): коллоксилин (10,7-12,2%), пироксилин № 2 (12,2-12,5%) и пироксилин № 1 (13,0-13,5%); известен также особый вид Н. ц., открытый Д. И. и названный им пироколлодием (12,4%). Плотность Н. ц. 1,58-1,65 г/см 2, средняя степень полимеризации коллоксилина 150-600 (молярная масса 37 500-150 000), пироксилинов 1000-2000 (молекулярная масса 250 000-500 000). Растворимость Н. ц. зависит от содержания азота; растворителем для всех служит ацетон; Н. ц. нерастворимы в воде и неполярных растворителях (например, в бензоле, четырёххлористом углероде, бензине); они не стойки к действию кислот и щелочей; разбавленные минеральные кислоты вызывают медленный гидролиз, а щелочи омыляют и разрушают их. Н. ц. обладают низкой атмосферо- и термостойкостью. При нагревании они начинают разлагаться уже при 40-60 °С, причём скорость разложения быстро возрастает с повышением температуры. При быстром нагревании распад Н. ц. может закончиться вспышкой и взрывом. Введение в Н. ц. стабилизаторов (дифениламина, производных мочевины) позволяет повысить их стойкость. Н. ц. получают нитрованием разрыхлённой и высушенной целлюлозы .Полученный продукт многократно промывают водой, раствором соды, опять водой и, если необходимо, обезвоживают (например, этиловым спиртом). Товарный продукт хранят с содержанием 20-40% воды или спирта. Назначение Н. ц. определяется содержанием в них азота. Коллоксилин применяют для производства целлулоида, пластмасс (этролов), в небольших количествах для кино- и фотоплёнки, для получения нитролаков, нитроклеев и нитроэмалей. Пироксилины применяют для получения , и др. взрывчатых веществ. Основной недостаток Н. ц. - горючесть, поэтому они вытесняются ацетатами целлюлозы и синтетическими полимерами. Н. ц. - одни из первых полимерных материалов, впервые полученные французским химиком А. Браконно в 1832. Лит.:Роговин 3. А., Химия целлюлозы, М., 1972. В. Н. Кряжев. Нитриды Нитри'ды, соединения азота с более электроположительными элементами, главным образом с металлами. По строению и свойствам Н. подразделяются на три группы: 1) солеобразные Н. металлов I и II групп периодической системы Менделеева, легко разлагающиеся водой с образованием аммиака: Mg 3N 2+ 6H 2O = 3Mg(OH) 2+ 2NH 3 2) ковалентные Н. неметаллов, а также Al, Ga, In, Tl. Эти Н. (особенно AlN, BN, Si 3N 4) исключительно устойчивы к химическим воздействиям, тугоплавки, термостойки, являются диэлектриками или полупроводниками; особенно важен ; 3) металлоподобные Н. переходных металлов (наиболее многочисленная группа). Их строение определяется тем, что атомы азота внедряются в кристаллическую решетку металла; такие Н. во многих случаях не отвечают правилам формальной валентности и представляют (ZrN, Mn 4N, W 2N) с широкими областями гомогенности, в пределах которых происходит существенное изменение их свойств. Такие Н. во многом похожи на - имеют высокие электро- и теплопроводность, тугоплавки (например, TiN и HfN плавятся соответственно при 3200 и 3380 °С); отличаются от металлов высокой твёрдостью, хрупкостью, непластичностью. Металлоподобные Н. обладают высокой химической стойкостью. Н. образуются на поверхности металлов под действием азота или аммиака при 500-900 °С; нитридные покрытия придают металлическим изделиям твёрдость, износостойкость, коррозионную стойкость. Изделия из Н. применяются в технике высоких температур, газотурбостроении, энергетике, космической технике. Некоторые металлоподобные Н. - сверхпроводники (например, NbN и MoN проявляют сверхпроводимость соответственно при 15,6 К и 12 К); полупроводниковые и электроизоляционные свойства Н. используются в технике полупроводников. Лит.:Самсонов Г. В., Нитриды, К., 1969. Г. В. Самсонов. Нитрилы Нитри'лыкарбоновых кислот, цианистые соединения, RC a N, органические производные синильной кислоты. Их структурные изомеры - . Первый представитель ряда - HCN (формонитрил). Низшие алифатические Н. - жидкости с неприятным запахом, высшие - твёрдые кристаллические вещества, простейший ароматический Н. бензонитрил - бесцветная жидкость с приятным запахом горького миндаля; некоторые свойства Н. приведены в таблице.
* При 41°С. ** d 15 15. Н. восстанавливаются до первичных аминов RNH 2; Н. с ненасыщенными углеводородными остатками легко полимеризуются. Например, в промышленности полимеризацией получают . Формонитрил, или синильную кислоту, HCN, применяют в производстве акрилонитрила, метакрилонитрил - для получения органического стекла. Под действием кислот и щелочей Н. гидролизуются до карбоновых кислот (II): 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 |
|||||||||||||||||||||||||
 ) до нескольких сот
мкми большое отношение длины к диаметру (обычно более 100). Известны самородные волокнистые кристаллы Au, Ag, Cu, Sn, Pb, S, различных окислов и силикатов. Часто природные Н. к. встречаются в виде включений внутри др. минералов (например, иглы рутила в природных кристаллах рубина, кварца).
) до нескольких сот
мкми большое отношение длины к диаметру (обычно более 100). Известны самородные волокнистые кристаллы Au, Ag, Cu, Sn, Pb, S, различных окислов и силикатов. Часто природные Н. к. встречаются в виде включений внутри др. минералов (например, иглы рутила в природных кристаллах рубина, кварца).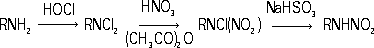 (2)
(2)